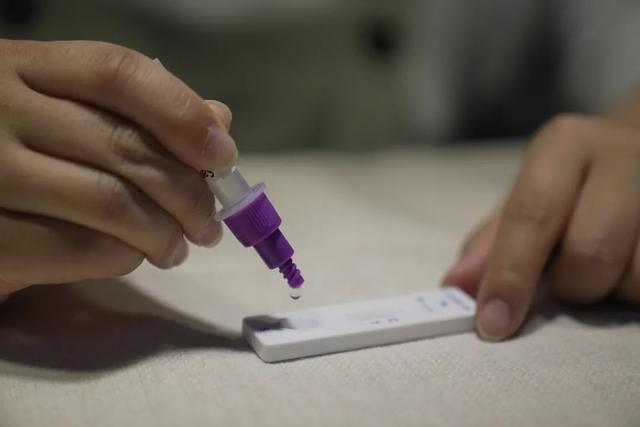
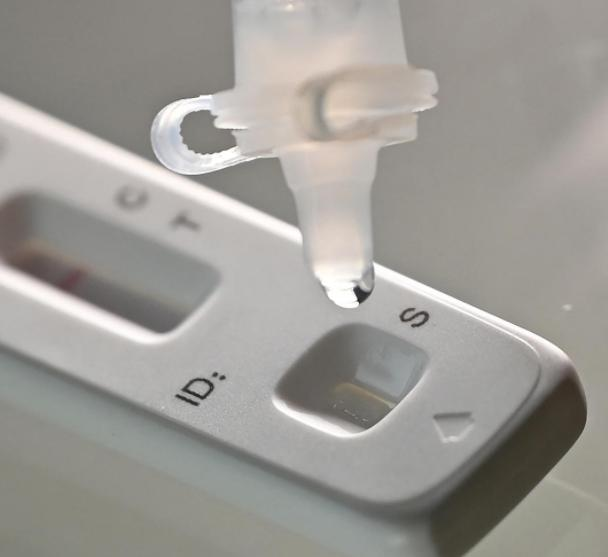
Am 12. Märzth 2022, DieNMPA (SFDA) hat eine Mitteilung herausgegeben, in der die Änderung der Anwendung für den Selbsttest von COVID-19-Antigenprodukten durch Nanjing Vazyme Biotech genehmigt wirdCo., Ltd, Beijing Jinwofu Bioengineering TechnologyCo., Ltd, Shenzhen Huada Yinyuan Pharmazeutische Technologie Co., Ltd., Guangzhou Wondfo Biotech Co., Ltd UndBEijing Savant Biotechnology Co., Ltd.(Huaketai). Fünf COVID-19-Antigen-Selbsttests wurden auf den Markt gebracht.
Am 11. März 2022 gab das NHC bekannt, dass das umfassende Team des gemeinsamen Präventions- und Kontrollmechanismus des Staatsrats zur weiteren Optimierung der Teststrategie für das neuartige Coronavirus und zur Erfüllung der Anforderungen der Prävention und Kontrolle von COVID-19 beschlossen habe, den Nukleinsäuretests Antigentests hinzuzufügen und das „Anwendungsprotokoll für den Antigennachweis des neuartigen Coronavirus (Test)“ erstellt habe.
Das Protokoll gibt die für den Antigentest infrage kommende Bevölkerungsgruppe an:
Erstens diejenigen, die medizinische Einrichtungen der Primärversorgung aufsuchen und innerhalb von 5 Tagen nach Auftreten der Symptome Symptome wie Atemwegserkrankungen und Fieber aufweisen;
Zweitens Quarantäne-Beobachtungspersonal, einschließlich Personal für die Beobachtung der Heimquarantäne, Personal für engen und subengen Kontakt, Personal für die Beobachtung der Einreisequarantäne sowie Personal für Eindämmungsbereiche und Kontrollbereiche;
Die dritte Gruppe sind die Einwohner der Gemeinde, die einen Antigen-Selbstnachweis benötigen.
Tipps: Der Antigennachweis ist eine wichtige Ergänzung zum Nukleinsäurenachweis, die Ergebnisse des Antigen-Selbstnachweises können jedoch nicht als Grundlage für die Diagnose einer Infektion verwendet werden
Veröffentlichungszeit: 22. März 2022