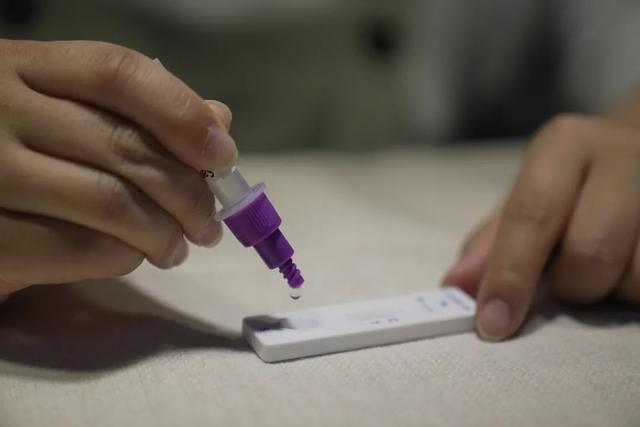
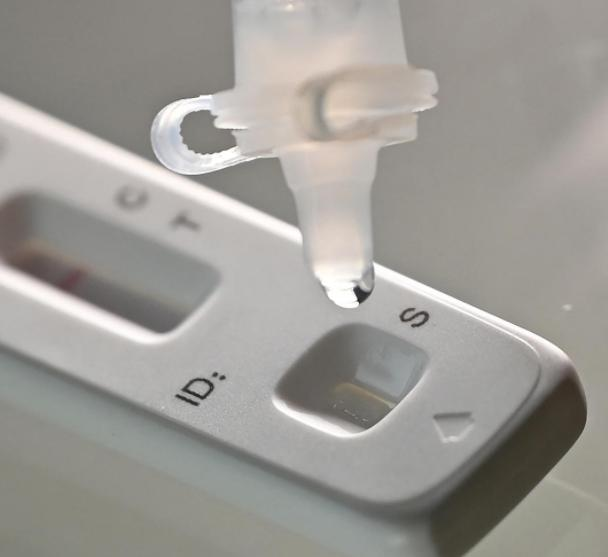
Le 12 marsth 2022, leNMPA (SFDA) a publié un avis approuvant le changement de demande d'autotest des produits antigéniques COVID-19 par Nanjing Vazyme BiotechCo., LtdTechnologie de bio-ingénierie Jinwofu de PékinCo., Ltd, Shenzhen Huada Yinyuan Pharmaceutical Technology Co., Ltd, Guangzhou Wondfo Biotech Co., Ltd etBeijing Savant Biotechnology Co., Ltd.(Huaketaï)Cinq produits d’autotest antigénique COVID-19 ont été lancés.
Le 11 mars 2022, la NHC a annoncé que, afin d'optimiser davantage la stratégie de dépistage du nouveau coronavirus et de répondre aux besoins de prévention et de contrôle du COVID-19, l'équipe globale du mécanisme conjoint de prévention et de contrôle du Conseil d'État a décidé d'ajouter les tests antigéniques aux tests d'acide nucléique et a établi le « Protocole d'application pour la détection des antigènes du nouveau coronavirus (essai) ».
Le protocole précise la population applicable aux tests antigéniques :
Premièrement, ceux qui consultent des établissements médicaux primaires et présentent des symptômes tels que des problèmes respiratoires et de la fièvre dans les 5 jours suivant l’apparition des symptômes ;
Deuxièmement, le personnel d’observation de la quarantaine, y compris l’observation de la quarantaine à domicile, les contacts étroits et les contacts sous-étroits, l’observation de la quarantaine à l’entrée, le personnel de la zone de confinement et de la zone de contrôle ;
Le troisième groupe concerne les résidents de la communauté qui ont besoin d’une auto-détection d’antigènes.
Conseils : La détection d'antigènes est un complément important de la détection d'acides nucléiques, mais les résultats de l'auto-détection d'antigènes ne peuvent pas être utilisés comme base pour le diagnostic d'une infection.
Date de publication : 22 mars 2022