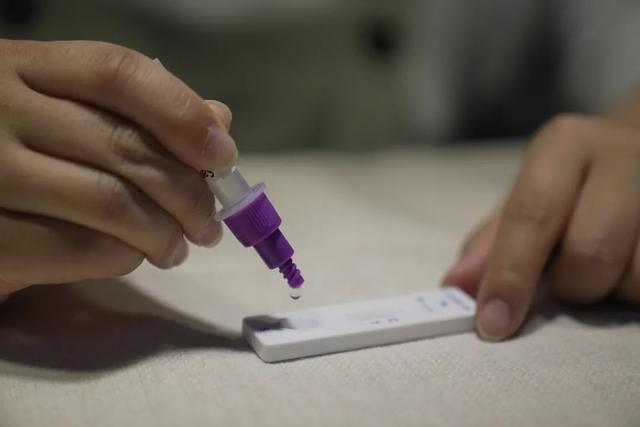
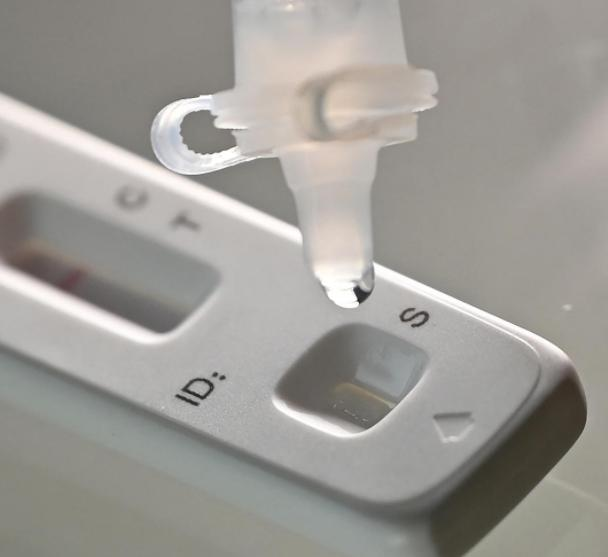
Pada tanggal 12 Maretth tahun 2022, ituNMPA (SFDA) mengeluarkan pemberitahuan yang menyetujui perubahan aplikasi untuk uji mandiri produk antigen COVID-19 oleh Nanjing Vazyme BiotechPerusahaan TerbatasTeknologi Bioteknologi Jinwofu BeijingPerusahaan Terbatas, Shenzhen Huada Yinyuan Pharmaceutical Technology Co., Ltd, Guangzhou Wondfo Biotech Co., Ltd DanBeijing Savant Biotechnology Co.,ltd(Huaketai)Lima produk uji mandiri antigen COVID-19 telah diluncurkan.
Pada tanggal 11 Maret 2022, NHC telah mengumumkan bahwa, untuk lebih mengoptimalkan strategi pengujian Virus Corona Baru dan melayani kebutuhan pencegahan dan pengendalian COVID-19, Tim Komprehensif Mekanisme Pencegahan dan Pengendalian Gabungan Dewan Negara memutuskan untuk menambahkan pengujian antigen ke pengujian asam nukleat dan membuat “Protokol Aplikasi untuk Deteksi Antigen Virus Corona Baru (Uji Coba)”
Protokol ini menentukan populasi yang berlaku untuk pengujian antigen:
Pertama, mereka yang mengunjungi institusi medis primer dan memiliki gejala seperti saluran pernapasan dan demam dalam 5 hari sejak timbulnya gejala;
Kedua, petugas observasi karantina, meliputi petugas observasi karantina rumah, kontak erat dan sub-kontak dekat, petugas observasi karantina masuk, petugas area penahanan dan area pengendalian;
Ketiga, warga masyarakat yang memiliki kebutuhan deteksi antigen mandiri.
Tips: Deteksi antigen merupakan pelengkap penting deteksi asam nukleat, namun hasil deteksi diri antigen tidak dapat dijadikan dasar diagnosis infeksi.
Waktu posting: 22-Mar-2022